Temodinámica es el estudio de las transformaciones energéticas que acompañan los cambios físicos y químicos de la materia. Le interesa solo los estados inicial y final.
Las leyes de la termodinámica son:
1. "La energía ni se crea ni se destruye"
2. El desorden del universo aumenta siempre. Los procesos físicos y químicos sólo se producen espontáneamente cuando aumenta el desorden.
∆Suniverso= ∆Sentorno + ∆Ssistema
Conceptos concernientes al tema:
SISTEMA: Espacio físico donde se dan las reacciones
ALREDEDORES: Entornos del sistema
UNIVERSO: sistema+alrededores
Tipos de sistemas:
1. Aislados: No hay intercambio de energía o materia
2. Cerrados: Hay intercambio de energía, pero no de materia
3. Abiertos: Hay intercambio de energía y de materia
Energía libre de Gibbs G: Expresa la cantidad de energía para realizar un trabajo.
∆H: Es el contenido del calor en el sistema reactante.
Entropia S: Es la expresión cuantitativa de aletoriedad o desorden de un sistema.
La ecuación de la energía libre de Gibbs es:
∆G= ∆H - T∆S
∆S= Sf - SI
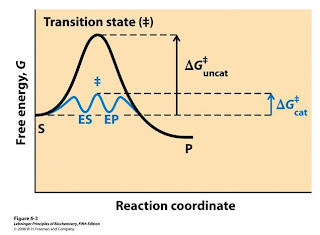
Cuando no hay equilibrio en la reacción, la tendencia a moverse al equilibrio representa la fuerza directriz ∆G°
La entropía es el valor numérico que se le da al desorden presente en el universo.Adicionalmente se tiene ∆G'°= -RTLnKeq.
Esta medida es utilizada a condiciones estándar 298K, 1M, 1atm, pH= 7
∆G= ∆G'° + RT LnKeq
Cuando hay más moléculas se aumente el desorden y, por ende, se favorece la reacción.
La reacción se produce espontáneamente cuando la energía del producto es menos que la del reactante.
Estructura y función de la mitocondria
La mitocondria tiene:
- Dos membranas
ATPasas (Complejo FoF1)
Proteínas de transporte e-
Complejos lanzadera
76% del peso total
• Membrana externa: contiene porinas (canal protéico), iones y moléculas pequeñas que pasan libremente a través de las porinas
• Una membrana interna invaginada
La matriz contiene enzimas del ciclo TCA (y otras) enzimas solubles
La membrana interna contiene transportadores de metabolitos y la cadena de transporte de electrones.
ATP: Adenosín trifosfato, se refiere a una unidad energética empleada en los seres vivos.
La función de la mitocondria es brindarle energía a la célula, por medio de procesos que involucran oxígeno y otros que no, en la glicólisis se obtienen 2ATP (proceso anaeróbico), en contraposición en el Ciclo de Krebs, Transporte de electrones y fosforilación oxidativa. (los últimos son aerobios) se obtienen 32 ATP, lo que denota que son mucho más eficientes, energéticamente hablando, los procesos aeróbicos.
Títulos y URL relacionados con los temas asignados:
• Mitochondrial carriers function as monomers
URL: http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6T1S-4YRHCWC-3&_user=10&_coverDate=07%2F31%2F2010&_rdoc=1&_fmt=high&_orig=search&_origin=search&_sort=d&_docanchor=&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=874fdb2e1fb3d3291f800afb5d8ca393&searchtype=a
Kunji Edmund R.S, Crichton Paul G. Mitochondrial carriers function as monomers. Science direct [internet] 2010; 1797: 817-831 [consultado 2010 octubre 10]. Disponible en http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6T1S-4YRHCWC-3&_user=10&_coverDate=07%2F31%2F2010&_rdoc=1&_fmt=high&_orig=search&_origin=search&_sort=d&_docanchor=&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=874fdb2e1fb3d3291f800afb5d8ca393&searchtype=a
• Lower succinyl-CoA:3-ketoacid-CoA transferase (SCOT) and ATP citrate lyase in pancreatic islets of a rat model of type 2 diabetes: knockdown of SCOT inhibits insulin release in rat insulinoma cells.
URL: http://www.ncbi.nlm.nih.gov/pubmed/20460097?dopt=Abstract
Hasan Noaman M, Longacre Melissa J, Seed Ahmed Mohammed, Kendrick Mindy A, Gu Harvest, Ostenson Claes-Goran, Fukao, Toshiyuki, MacDonald, Michael J. Lower succinyl-CoA:3-ketoacid-CoA transferase (SCOT) and ATP citrate lyase in pancreatic islets of a rat model of type 2 diabetes: knockdown of SCOT inhibits insulin release in rat insulinoma cells. Medline [internet] 2010; 499 (1-2): 62-68 [consultado 2010 octubre 10]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/20460097?dopt=Abstract
Los anteriores dos artículos son procedentes con el tema que se está tratando, porque ahondan en él y pretenden encontrar una aplicación en el día a día, buscan encontrar respuestas a enigmas o resolver cuestiones de la vida común.
Es importante tratar temas de la realidad, porque en tanto se aborden, se realicen preguntas de ésta y se procure resolverlas, entonces, tendremos una mejor comprensión de lo que somos, qué queremos ser y cómo hemos de mejorar lo que somos, como entes de este mundo.